Gli API (Active Pharmaceutical Ingredients) sono le materie prime farmacologicamente attive la cui qualità e tracciabilità è di fondamentale importanza. Secondo la normativa attualmente vigente, D.lgs 219/2006, in Italia, la produzione e importazione di API devono essere autorizzate dall’autorità regolatoria competente (AIFA) . Per approfondire l’argomento ne abbiamo parlato con Marcello Fumagalli, General Manager di CPA Italy.
Cominciamo con una definizione preliminare: quali differenze tra API e intermedi?
API è l’acronimo internazionale per Active Pharmaceutical Ingredients, in italiano Principi Attivi Farmaceutici. Essi sono gli ingredienti chimici “attivi”, contenuti nei farmaci, la cui funzione principale è quella di agire sull’organismo esercitando l’effetto terapeutico desiderato. In altre parole, che curano, prevengono o diagnosticano una malattia. Nel farmaco formulato si distinguono dagli eccipienti il cui ruolo è ancillare, ma necessario per la produzione delle forme farmaceutiche per le quali è stato studiato il “medicinale”. La produzione degli “API” avviene in impianti chimici specializzati in cui si rispettano rigidi standard di qualità e sicurezza imposti dalle norme e dalle autorità sanitarie mondiali. La sintesi dei Principi Attivi Farmaceutici (API) solitamente è un processo chimico difficile che combina diversi passaggi di chimica organica avanzata, ingegneria di processo e un sistema di controllo qualità rigoroso. Ogni fase della sintesi prevede la produzione di quelli che sono chiamati “intermedi” ognuno dei quali, a loro volta, partecipa a realizzare la molecola finale dell’API. Le differenti tecnologie chimiche si susseguono concludendosi nei controlli analitici garanti della purezza chimica, della stabilità e della conformità del prodotto farmaceutico agli standard e alle specifiche previste. Dopo questo lungo processo il principio attivo farmaceutico è trasformato in una forma adatta alla somministrazione (polvere, granuli, liquido) e con l’ausilio della combinazione con gli eccipienti nel farmaco formulato.
Produzione: sintesi o fermentazione? Quali sono i vantaggi dell’una e dell’altra?
Ottima domanda: la sintesi chimica e la fermentazione sono due tecnologie molto differenti per produrre ingredienti farmaceutici attivi e ponendole a confronto si possono cogliere le principali diversità. Per la sintesi chimica, abbiamo già detto che è un processo complesso formato da una sequenza di reazioni chimiche controllate partendo da molecole semplici, mentre la fermentazione è viceversa una tecnologia naturale fondata sull’abilità biologica di microrganismi(come batteri o lieviti) nel produrre il principio attivo farmaceutico attraverso il loro metabolismo. Le tecnologie di reazione chimica di sintesi richiedono alte temperature, pressione e solventi organici che generarono scarti tossici a loro volta oggetti di trattamenti ambientali. D’altro canto, la sintesi é precisa e scalabile ed ideale per la produzione di molecole piccole e stabili. I vantaggi della fermentazione sono invece legati alle condizioni blande dei processi ove tutti i parametri si presentano in forma moderata. Inoltre, la fermentazione genera basse quantità di rifiuti, utilizza enzimi naturali come catalizzatori ed è ideale per sintesi di molecole complesse o “chirali” difficilmente ottenibili per via di sintesi chimica. Nella Tabella 1 è riassunto in breve il confronto tra le due tecnologie consegnandoci un’idea degli svantaggi e vantaggi delle singole.
Tabella 1
| Aspetto | Sintesi Chimica | Fermentazione |
| Tipo di processo | Reazioni chimiche | Metabolismo cellulare |
| Condizioni operative | Estreme (T°, pH, solventi) | Miti e naturali |
| Impatto ambientale | Più elevato | Più sostenibile |
| Complessità molecolare | Limitata | Elevata (chirali, proteine) |
| Scalabilità | Alta | Dipende dal microrganismo |
Altri vantaggi della sintesi chimica si possono riassumere nella seguente immagine:
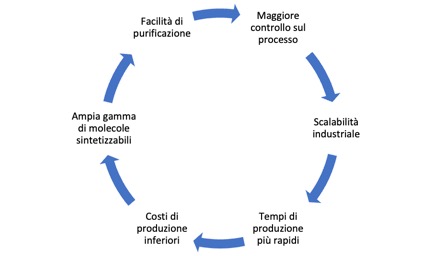
| La sintesi chimica è preferibile quando? | Perché si preferisce la sintesi chimica? |
| Gli API sono semplici, non chirali e termicamente stabili | Permette di ottenere elevata purezza e controllo stereochimico |
| Si richiede rapidità, economicità e alta produttività | È più adatta per molecole non naturali e stabili |
| La fermentazione non è praticabile per motivi tecnici o regolatori | Consente una produzione su larga scala con costi contenuti |
Naturalmente, la fermentazione ha i suoi punti di forza, soprattutto per molecole complesse come antibiotici, ormoni o proteine terapeutiche.
Quali sono i problemi, legati alla sicurezza nel processo di produzione che utilizza la sintesi chimica e quali quelli legati alla fermentazione?
La sintesi chimica degli API, pur essendo altamente efficiente, comporta diversi problemi legati alla sicurezza che devono essere gestiti con attenzione per proteggere i lavoratori, l’ambiente e i prodotti.
Tabella 2
| Rischi chimici e tossicologici | Molti reagenti e solventi utilizzati sono infiammabili, corrosivi o tossici |
| I lavoratori possono essere esposti a vapori, polveri o liquidi nocivi, con rischi di intossicazione acuta o effetti cronici | |
| Rischi di incendio ed esplosione | Alcune reazioni chimiche sono esotermiche e possono generare gas infiammabili |
| La presenza di solventi organici volatili aumenta il rischio di esplosioni se non gestiti correttamente | |
| Residui e scarti chimici | La sintesi genera sottoprodotti e rifiuti pericolosi che devono essere smaltiti secondo normative ambientali |
| Potenziale contaminazione suolo, acqua e aria, con impatti ecologici significativi | |
| Problemi di conformità GMP | Le linee guida ICH Q7 impongono standard rigorosi per la produzione sicura degli API |
| La mancata applicazione di buone pratiche può portare a non conformità, ritiri di prodotto e sanzioni regolatorie | |
| Contaminazione crociata | In impianti che producono più API, c’è il rischio che tracce di un principio attivo contaminino un altro |
| Compromissione sicurezza del farmaco e causare gravi effetti clinici |
I rischi specifici della fermentazione possono variare in relazione alla complessità del principio attivo farmaceutico che si vuole ottenere. Nella Tabella 3 ho voluto riassumere una panoramica dettagliata dei principali problemi di sicurezza.
Tabella 3
| Contaminazione microbiologica | Contaminazioni da ceppi indesiderati possono compromettere la qualità del prodotto o generare tossine |
| Richiede ambienti sterili e sistemi di contenimento rigorosi | |
| Produzione di metaboliti tossici | Alcuni microrganismi possono produrre sottoprodotti indesiderati o metaboliti secondari tossici |
| È necessario monitorare costantemente il profilo metabolico del processo | |
| Rischi di pressione e gas | La fermentazione può generare gas che aumentano la pressione nei bioreattori |
| Se non gestiti correttamente, possono causare esplosioni o fuoriuscite pericolose | |
| Manipolazione genetica | Se si usano microrganismi geneticamente modificati ci sono rischi legati alla biosicurezza e alla dispersione ambientale |
| È obbligatorio seguire normative specifiche per il contenimento e la tracciabilità | |
| Igiene e pulizia degli impianti | I fermentatori devono essere sanificati regolarmente per evitare biofilm e contaminazioni crociate |
| Errori nella pulizia possono portare a non conformità e rischi per la salute pubblica | |
| Variabilità del processo | La fermentazione è meno prevedibile rispetto alla sintesi chimica |
| Piccole variazioni di temperatura, pH o nutrienti possono alterare la resa o la qualità dell’API |
Quali sfide vede all’orizzonte?
Le sfide all’orizzonte nella produzione di API sono molteplici e complesse, soprattutto in un contesto globale che cambia rapidamente. Un’ampia visione è stata oggetto della presentazione nella Sessione API del 64° Simposio AFI del Giugno 2025 estratta dallo studio di CPA dal titolo “Outlook of Active Pharmaceutical Ingredients: the post-pandemic reshaping”. Nella Tabella 4 sono sintetizzati i punti salienti che potranno avere un’incidenza nell’immediato e medio futuro.
Tabella 4
| Dipendenza da paesi terzi | La produzione di API è fortemente concentrata in India e Cina, che forniscono oltre il 60% degli API mondiali. |
| Questo crea vulnerabilità geopolitiche e rischi di interruzione della supply chain, come si è visto durante la pandemia | |
| Sostenibilità ambientale | I processi chimici tradizionali generano scarti tossici, consumano molta energia e utilizzano solventi pericolosi |
| Le normative ambientali stanno diventando più stringenti, spingendo verso processi verdi e chimica sostenibile | |
| Molecole sempre più complesse | I nuovi farmaci richiedono API chirali, biologici o peptidici, difficili da sintetizzare con metodi tradizionali |
| Questo impone l’adozione di biotecnologie avanzate, fermentazione, e biocatalisi | |
| Digitalizzazione e automazione | L’industria farmaceutica deve integrare intelligenza artificiale, machine learning e produzione in flusso continuo |
| Le aziende che non investono in queste tecnologie rischiano di perdere competitività | |
| Regolamentazione più rigorosa | Le autorità come EMA e FDA richiedono tracciabilità totale, qualità costante e conformità GMP |
| Questo aumenta i costi e la complessità dei processi produttivi | |
| Pressione sui prezzi e concorrenza globale | |
| I produttori devono bilanciare qualità, sicurezza e costo, in un mercato sempre più competitivo | |
| I farmaci generici spingono verso margini più bassi, rendendo difficile investire in innovazione |





